副作用
副作用及び臨床検査値異常
本剤投与時:抗HIV薬による治療経験があり、ウイルス学的に抑制されているHIV-1感染症患者を対象とした本剤の海外臨床試験(投与後48週時)において、333例中31例(9.3%)に副作用が認められました。主な副作用は、悪心4例(1.2%)、下痢4例(1.2%)等でした。 (承認時)
ゲンボイヤ配合錠投与時:抗HIV薬による治療経験がないHIV-1感染症患者を対象とした本剤有効成分を含むゲンボイヤ配合錠(エルビテグラビルとして150mg、コビシスタットとして150mg、エムトリシタビンとして200mg及びテノホビル アラフェナミドとして10mgを含有する抗HIV薬)の海外臨床試験(投与後96週時)において、866例中367例(42.4%)に副作用が認められました。主な副作用は、悪心90例(10.4%)、下痢63例(7.3%)、頭痛53例(6.1%)等でした。また、抗HIV薬による治療経験があり、ウイルス学的に抑制されているHIV-1感染症患者を対象としたゲンボイヤ配合錠の海外臨床試験(投与後96週時)において、959例中218例(22.7%)に副作用が認められました。主な副作用は、下痢25例(2.6%)、悪心22例(2.3%)等でした。 (承認時)
なお、重大な副作用として、腎不全又は重度の腎機能障害(1%未満)、乳酸アシドーシス(頻度不明)※が報告されています。
- エムトリシタビン又はテノホビル ジソプロキシルフマル酸塩を含有する製剤の臨床試験、製造販売後調査及び自発報告等で報告された副作用を示しました。
本剤は海外データに基づいて承認されています。
副作用発現頻度及び臨床検査値異常一覧
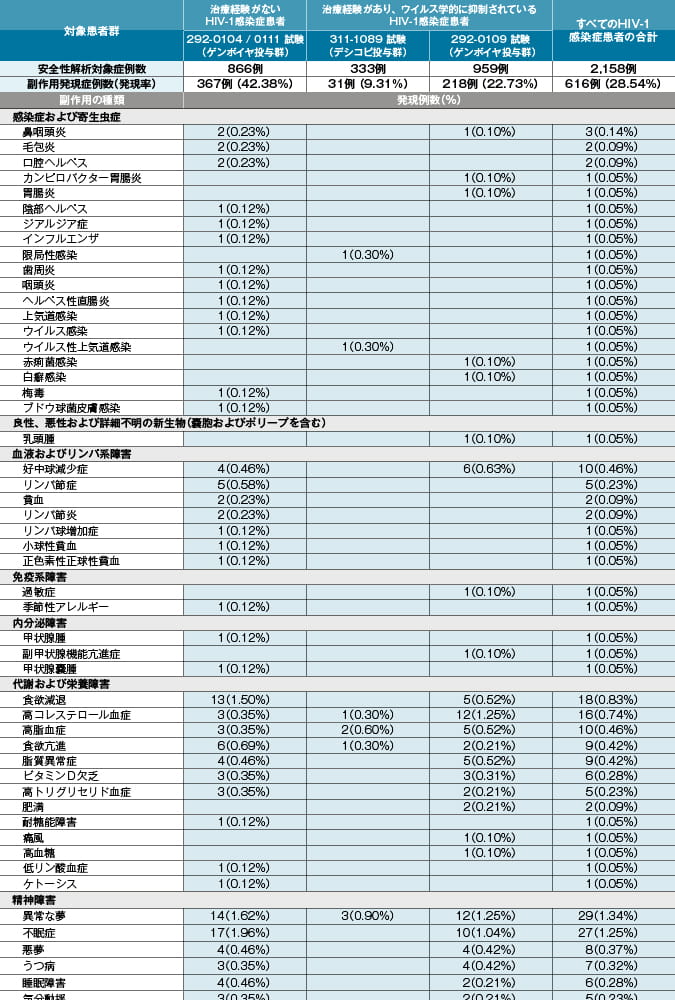
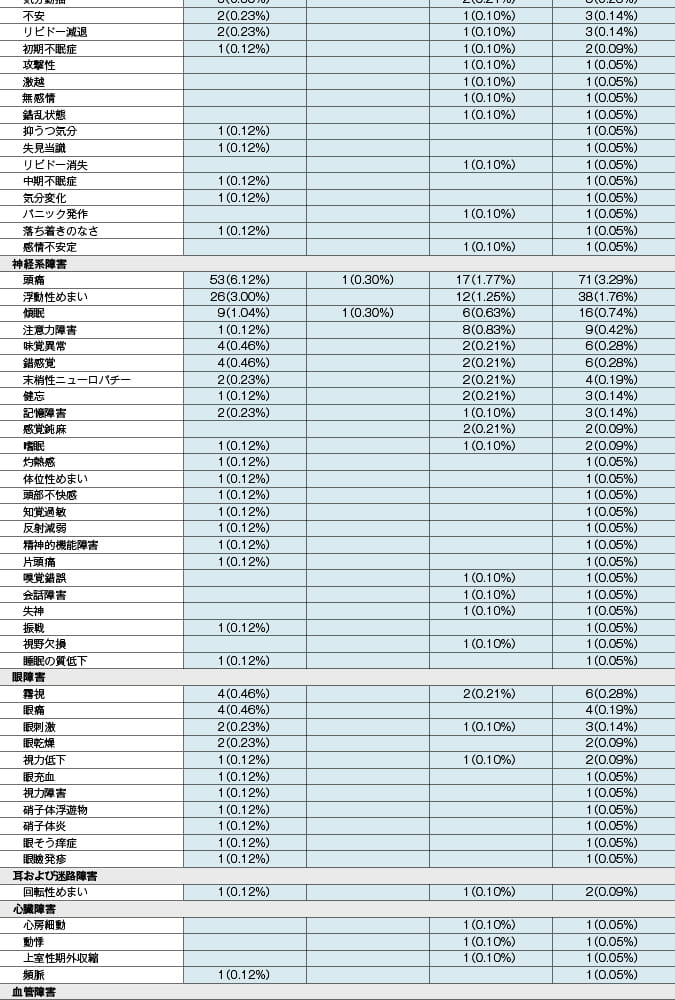
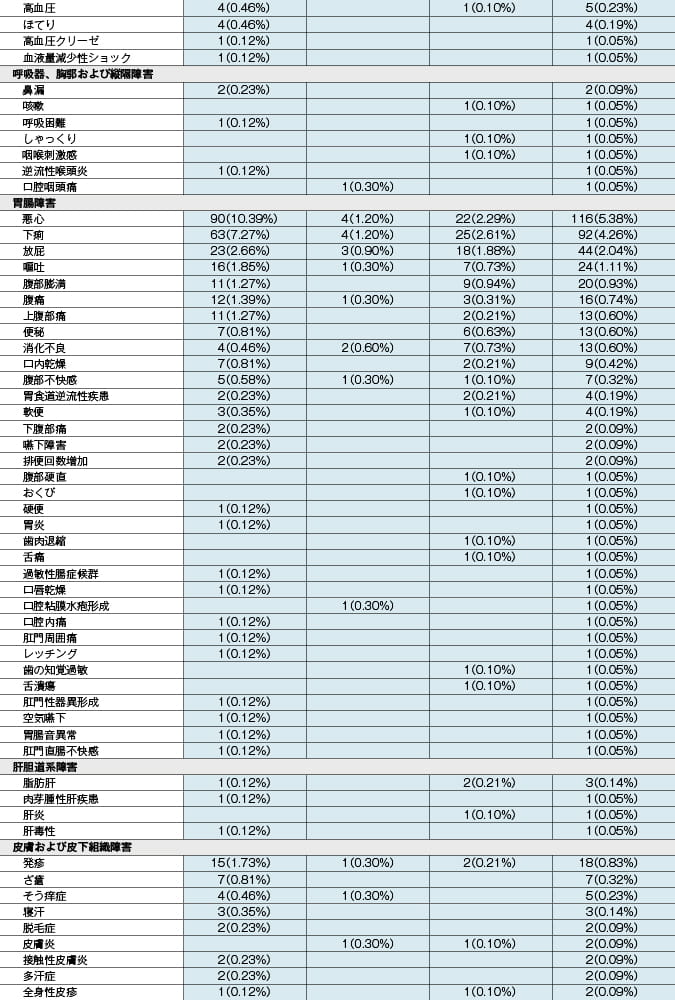
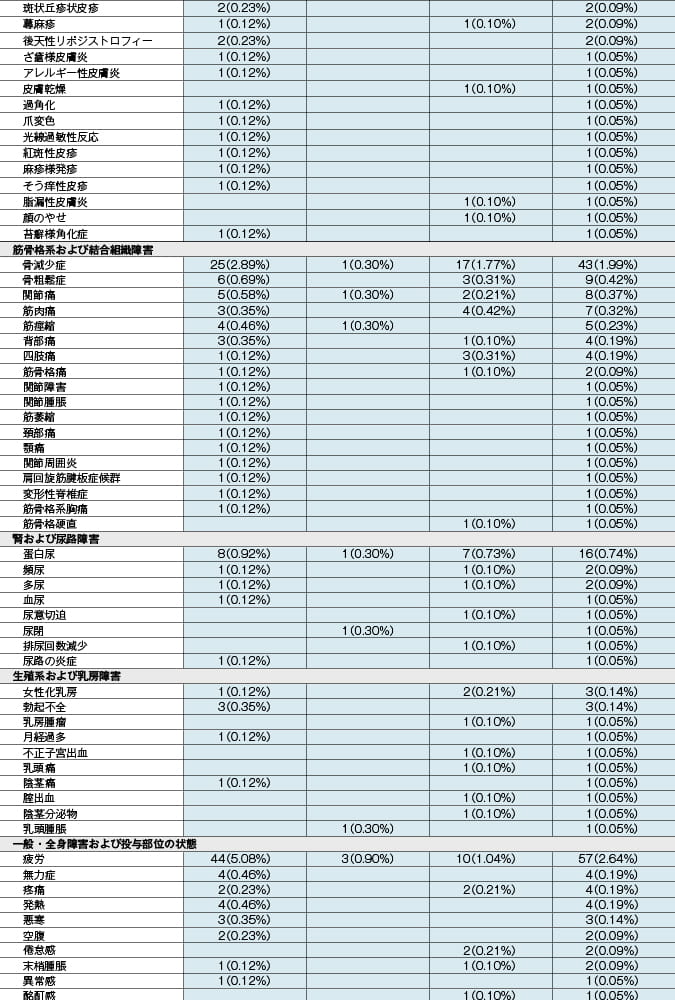
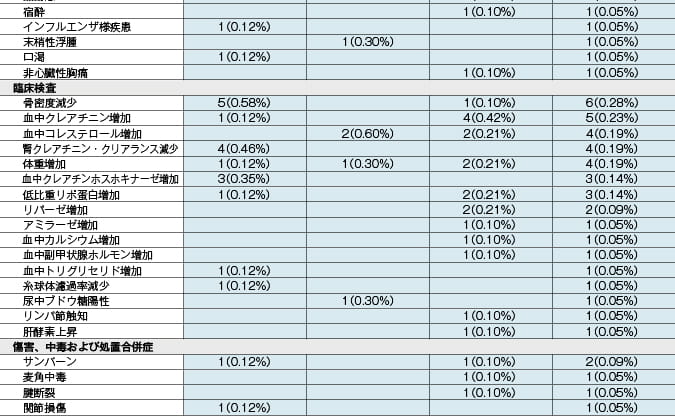
MedDRA/J version18.1 承認時社内集計
医薬品リスク管理計画書(RMP)






